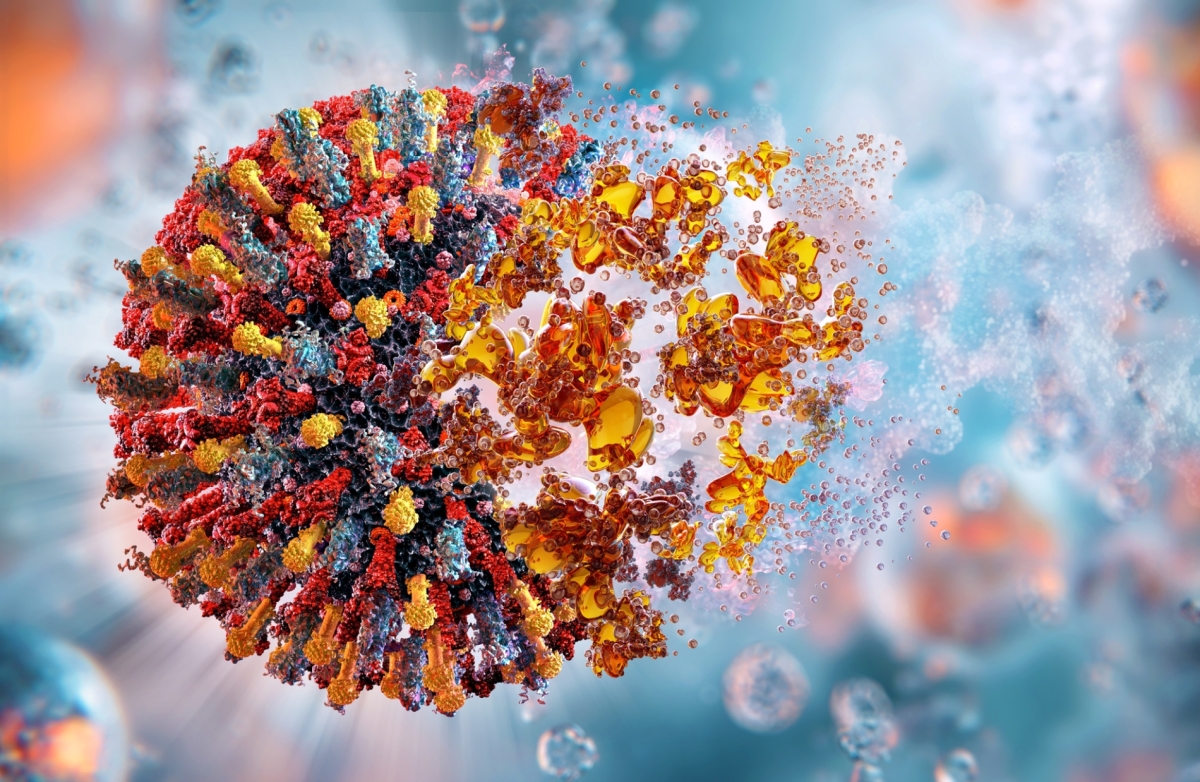
على مدى الخمسين عاما الماضية، تواصلت الجهود الحثيثة لتطوير لقاحات السرطان، لكن ورغم المجهود المبذول كان نجاح تلك اللقاحات محدودا للغاية. والآن، وبفضل الطفرات النوعية في مجالات علم الوراثة، والبيولوجيا الجزيئية، والكيمياء الحيوية، وعلم المناعة، تجدد الأمل في هذه العلاجات، وتمكن الباحثون من تطوير لقاح واعد قد ينجح في علاج أنواع محددة من السرطان.
وأعلنت هيئة الخدمات الصحية الوطنية في إنكلترا تسريع إدخال مرضى سرطان الرأس والرقبة إلى تجربة سريرية جديدة لاختبار لقاح مبتكر يُوصف بأنه "قد يغير قواعد اللعبة" في علاج هذه الأنواع من السرطان. وقد تلقى بعض المرضى بالفعل الجرعة الأولى من اللقاح، فيما ستتاح الفرصة لآخرين للتسجيل عبر مستشفياتهم المحلية خلال الأشهر المقبلة.
نشهد اليوم نقطة تحول جوهرية في مجال تطوير اللقاحات. فبعد الإطلاق الأخير للقاحات "كورونا" المستجد، أصبحت الفوائد التي ستعود على صحة الإنسان والاقتصاد العالمي أمرا لا يمكن إنكاره، وقد شجع النجاح في تطوير أول لقاح موثق ضد الجدري في عام 1796 على اكتشاف واعتماد لقاحات جديدة للوقاية من الأمراض الناجمة عن مسببات الأمراض المعروفة والناشئة.
وبعد أكثر من 220 عاما منذ أن أصبح التطعيم ضد الجدري أمرا روتينيا، وأدى إلى القضاء على المرض عالميا، وافقت إدارة الغذاء والدواء الأميركية على أقل من 100 لقاح للأمراض المعدية، مما يسلط الضوء على النجاحات العديدة، ويذكرنا في الوقت نفسه بالتحديات التي لا تزال قائمة في عملية صناعة اللقاحات.
فصناعة اللقاحات تواجه تحديات معقدة تبدأ من المراحل الأولى للبحث والتطوير، إذ يتطلب الأمر فهما دقيقا لآليات الجهاز المناعي وتحديد المستضدات الأكثر فعالية في تحفيز استجابة واقية. تضاف إلى ذلك صعوبة إنتاج لقاحات ضد أمراض تتحور بسرعة مثل فيروسات الإنفلونزا أو فيروس نقص المناعة، مما يجعل اللقاح سريع الفقدان لفاعليته.
كما أن اختبارات السلامة والفعالية في التجارب السريرية تحتاج إلى سنوات طويلة وتكاليف باهظة، مع وجود أخطار لفشل اللقاحات المرشحة في المراحل المتأخرة. ولا تقف التحديات عند الجانب العلمي فقط، بل تمتد إلى مشكلات الإنتاج الضخم، وسلاسل التبريد والنقل، خاصة في اللقاحات الحساسة مثل لقاحات الحمض النووي، إضافة إلى قضايا الثقة المجتمعية ومقاومة بعض الفئات للتطعيم، مما يعيق الوصول إلى المناعة المجتمعية الشاملة.